
5月31日,康方AK112的HARMONi-2研究結果發(fā)布,稱(chēng)其在頭對頭試驗中擊敗了K藥,顯著(zhù)提高了患者的無(wú)進(jìn)展生存期(PFS),超預期改善了風(fēng)險比(HR)。
但在默沙東EliavBarr博士接受FiercePharma采訪(fǎng)時(shí)看來(lái),其成功雖不可否認,但需要后續更多OS數據的進(jìn)一步證實(shí),畢竟就有效性而言,如“可樂(lè )療法”等多種治療方案在過(guò)去也曾取得過(guò)更優(yōu)秀的疾病進(jìn)展或更低的死亡風(fēng)險,后續卻都折戟于總生存期指數上(可樂(lè )療法有10%的負面趨勢)。
加之,如今FDA對于創(chuàng )新藥療法的OS指數愈發(fā)看重,AK112要想在一線(xiàn)NSCLC中獲得FDA的批準,基于以往PD-1/VEGF組合的經(jīng)驗,這可能是一個(gè)挑戰,言外之意似乎是說(shuō),AK112要想在OS數據上擊敗K藥似乎難度不小。
如此,考慮到目前創(chuàng )新藥出海的整體局勢,或許OS還將是AK112繞不開(kāi)的坎,更是中國創(chuàng )新藥繞不開(kāi)的坎。
FDA對OS的要求日益嚴格
多年以來(lái),FDA一直都是將PFS作為抗癌療法獲批的最主要指標,而在這項舉措之下,全球創(chuàng )新藥的獲批速度確實(shí)也得到大幅提升,大批創(chuàng )新藥得以順利上市。然而隨著(zhù)當下越來(lái)越多抗癌創(chuàng )新療法的誕生,創(chuàng )新藥企也被FDA要求提供更充分的證據,證實(shí)療法對延長(cháng)患者生存期的實(shí)質(zhì)性作用,言外之意就是臨床試驗中更金標準的“OS數據”。
畢竟,無(wú)論是臨床最終受益、藥物經(jīng)濟學(xué)、還是創(chuàng )新藥的最終歸屬,患者,尤其是晚期腫瘤患者對抗癌治療的需求都圍繞著(zhù)“能活多久”。FDA強調更可靠OS數據的要求,顯示了其致力于確保新的抗癌藥物不僅要有延緩疾病進(jìn)展的效果,同時(shí)也要在提高患者整體生存期和生活質(zhì)量方面有所作為。
2020年6月,FDA加速批準了Lurbinectedin(Zepzelca)的上市需求,使其成為自1996年以來(lái)首個(gè)FDA批準用于SCLC二線(xiàn)治療的新藥。其審批主要基于單臂試驗數據,彼時(shí)治療組與化療組對比并無(wú)顯著(zhù)的OS差異。
2022年2月10月,FDA拒絕批準了信達PD-1,要求其補充臨床試驗,除了多地區數據、頭對頭等要求外。也要求信達應以總生存期(OS)為終點(diǎn)。
2023年12月26日,FDA拒絕了安進(jìn)KRASG12C抑制劑Sotorasib從加速批準轉為完全批準的請求,其原因是Sotorasib相較于多西他賽,雖然PFS有改善,但是OS并沒(méi)有明顯提高。
三個(gè)時(shí)間段,分別是FDA對于創(chuàng )新藥上市申請數據的不同態(tài)度,FDA對于OS的要求正在愈發(fā)嚴格。
PFS的時(shí)代正在過(guò)去
PFS能被作為OS的替代指標,原因之一在于,其使臨床試驗能在更短時(shí)間內完成,且所需的樣本量更小,更快地證實(shí)臨床效益。當然,從患者角度來(lái)看,PFS也確實(shí)是一種“時(shí)效性”更強的指標,大多數情況下,PFS提升之下,即使OS并無(wú)提升,對于臨床上患者的“生活質(zhì)量”的改善也有著(zhù)顯著(zhù)改善,在整個(gè)治療過(guò)程中也顯得尤為重要。
但是,PFS與OS之間的正向相關(guān)性卻也并非絕對,其往往會(huì )因為多種原因而發(fā)生顛覆性變化,比如部分創(chuàng )新藥療法雖然早期PFS數據優(yōu)秀,但較大的副作用反而會(huì )對總生存期與生活質(zhì)量產(chǎn)生反向影響。
FDA腫瘤卓越中心主任RichardPazdur博士在去年7月份舉行的FDA-AACR行業(yè)聯(lián)合研討會(huì )上解釋說(shuō),PFS終點(diǎn)的長(cháng)期使用是在細胞毒性化療成為常規療法的情況下產(chǎn)生的,在此情形下,緩解率、疾病進(jìn)展和生存期之間存在很強的相關(guān)性。然而,當使用新型藥物進(jìn)行治療時(shí),這種情況可能并不總是正確的。
另外,PFS某種程度上還存在一定的主觀(guān)性,在alex研究中,研究者與獨立審評委員會(huì )的治療評估PFS上就存在9.1個(gè)月的差距;同時(shí),PFS對于免疫治療而言也呈現較明顯的局限性,有關(guān)研究中顯示,免疫治療與多西他賽相比,雖未達到延長(cháng)PFS的場(chǎng)景,但OS獲益明顯,這就是表示免疫治療存在假進(jìn)展或延遲效應,表明PFS在評估免疫治療的療效上存在滯后性。
FDA在《LancetOncology》上發(fā)布的一項匯總分析探究了ICI一線(xiàn)治療NSCLC時(shí)帶來(lái)的ORR和PFS獲益與總生存期(OS)的關(guān)系。結果顯示,在PD-L1>1%的患者里,無(wú)論是ORR還是PFS,對OS的預測都落在弱相關(guān)區域,尤其是PD-L1≥50%的患者,ORR對OS的預測處于極弱相關(guān)。這意味著(zhù),在該階段用ORR或PFS預測該類(lèi)患者的OS幾乎是一個(gè)隨機事件。
綜上所述,隨著(zhù)免疫治療時(shí)代的到來(lái),過(guò)去以PFS為主要終點(diǎn)的審批模式或許某種程度已不再完全適用,創(chuàng )新藥的PFS時(shí)代正在過(guò)去,創(chuàng )新藥企或許需要將更多重心放在OS數據上。
國產(chǎn)創(chuàng )新藥出海,OS是繞不開(kāi)的坎
以目前FDA對于OS的硬性態(tài)度來(lái)看,對于國內創(chuàng )新藥出海,其在未來(lái)極可能會(huì )因為OS試驗的復雜性而極大地延長(cháng)藥物獲批周期,使研發(fā)的時(shí)間與成本大幅上漲。
數據收集難度大:相比PFS數據的收集,收集和分析OS數據往往更為復雜和耗時(shí),需要較長(cháng)的隨訪(fǎng)時(shí)間和更大的樣本量。
數據解讀難度大:OS干擾因素繁雜,不同試驗不同群體都可能導致OS數據不夠準確,解讀困難大。
存在倫理考量:由于現有治療并不能保證生存周期內單用研究藥物,故隨訪(fǎng)過(guò)程中也許存在交叉治療的影響,最終導致OS數據不可信。
而對于近年來(lái)FDA對于臨床數據的態(tài)度改變,有了之前信達PD-1的前車(chē)之鑒,中國不少創(chuàng )新療法對于OS數據的前瞻布局也在順利推進(jìn)。近日召開(kāi)的ASCO大會(huì )上,已有部分的創(chuàng )新療法公布了最新的OS數據。
ASCO大會(huì )上部分國產(chǎn)新藥的PFS與OS數據
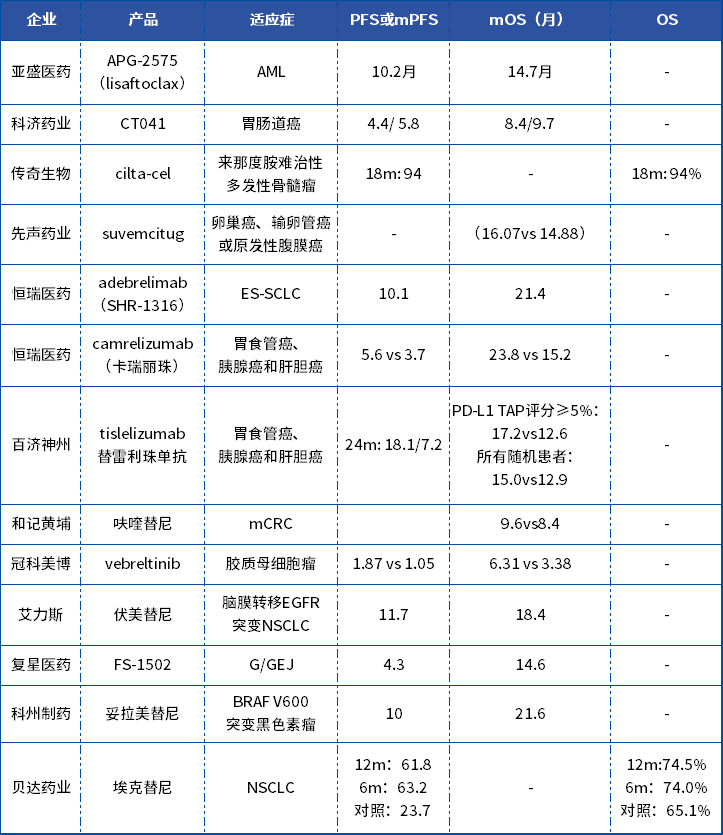
數據來(lái)源:2024ASCO大會(huì )
以恒瑞卡瑞利珠單抗為例,借ASCO大會(huì )的契機,ESCORT-1st研究的數據振奮人心,在聯(lián)合化療一線(xiàn)治療晚期ESCC上,不僅取得了7.6個(gè)月的中位PFS數據,同時(shí)在“生存期數據”上尤為重視,多項相關(guān)數據作為重點(diǎn)披露:
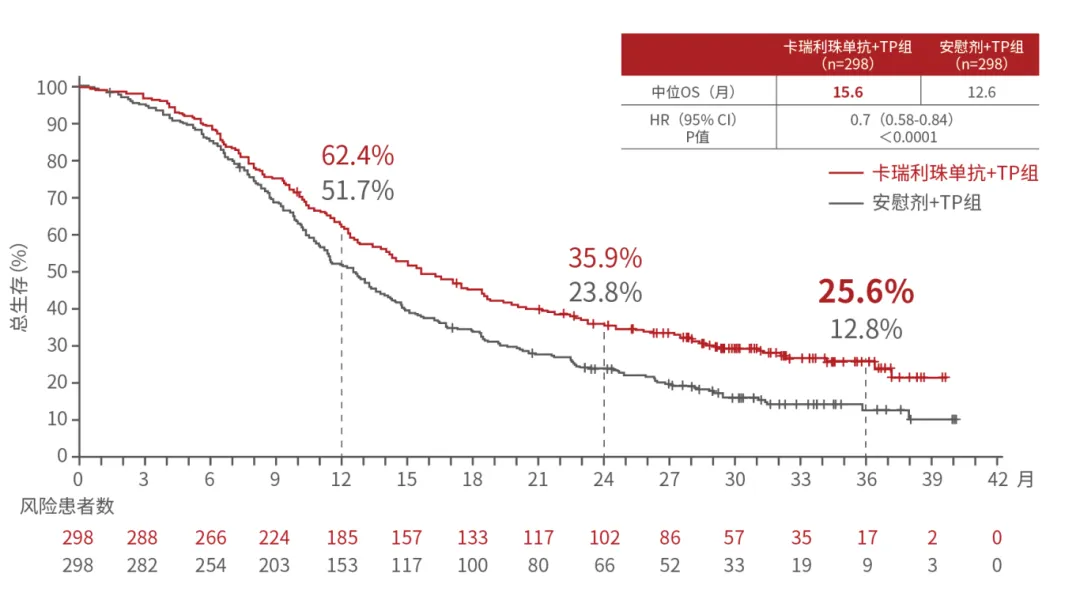
圖3:ESCORT-1st研究亞組生存曲線(xiàn)
圖片來(lái)源:醫脈通腫瘤科
中位總生存期(OS):15.6個(gè)月;
3年總生存率:25.6%(刷新現有一線(xiàn)免疫聯(lián)合化
PD-L1TPS<1%的3年生存率:從14.2%提升到24.4%;
PD-L1TPS≥1%的3年生存率:從11.4%躍升至25.9%;
小結
顯然,無(wú)論是從審批機構透露的指導意見(jiàn),還是創(chuàng )新藥企的臨床試驗計劃,亦或是披露數據的重點(diǎn)上,均可看出目前創(chuàng )新藥研發(fā)以OS為新重點(diǎn)的趨勢。
并且,隨著(zhù)靶向抗癌藥的持續普及,這個(gè)趨勢還將延續,新藥上市或許也將由快速時(shí)代進(jìn)入慢時(shí)代
轉載來(lái)源:藥智頭條

 京公網(wǎng)安備 11010802028547號
京公網(wǎng)安備 11010802028547號